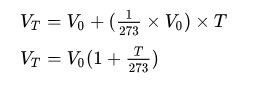Legea lui Charles
Legea lui Charles (cunoscută și ca legea volumelor) este o lege experimentală a gazelor care descrie modul în care gazele tind să se extindă atunci când sunt încălzite. O declarație modernă a legii lui Charles este:
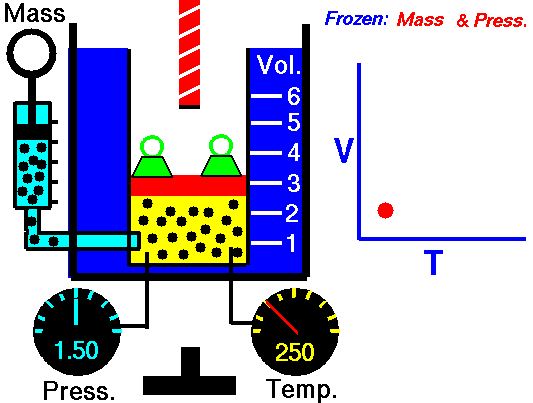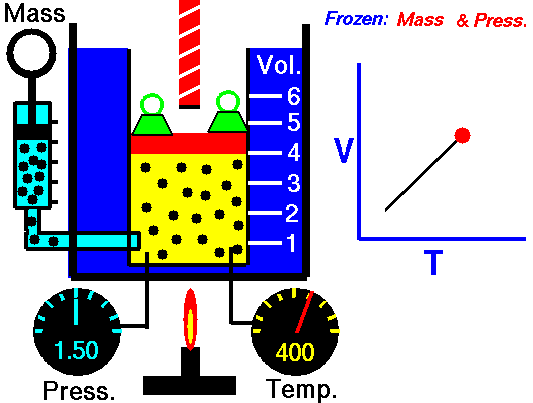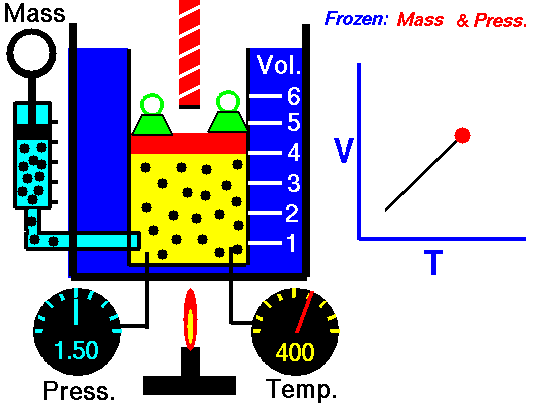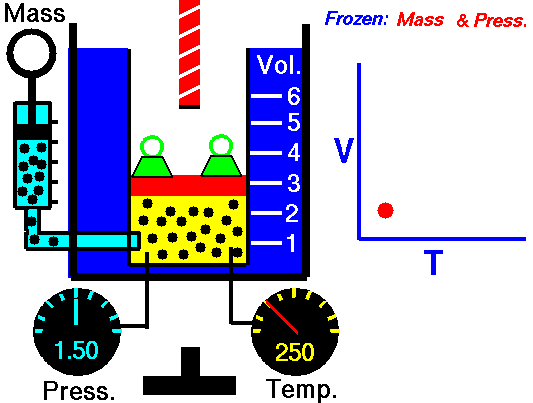
Când presiunea pe o probă de gaz uscat este menținută constantă, temperatura Kelvin și volumul vor fi direct proporționale.
Această lege descrie modul în care un gaz se extinde pe măsură ce temperatura crește; invers, o scădere a temperaturii va duce la o scădere a volumului.
Istoric
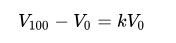
Principalele concluzii ale lui Dalton și Gay-Lussac pot fi exprimate matematic ca în această formulă, unde V100 este volumul ocupat de o probă dată de gaz la 100 °C; V0 este volumul ocupat de aceeași probă de gaz la 0 °C; iar k este o constantă care este aceeași pentru toate gazele la presiune constantă.
Legea a fost numită după omul de știință Jacques Charles, care a formulat legea originală în lucrarea sa nepublicată din anii 1780.
În două dintr-o serie de patru eseuri prezentate între 2 și 30 octombrie 1801, John Dalton a demonstrat prin experiment că toate gazele și vaporii pe care le-a studiat s-au extins cu aceeași cantitate între două puncte fixe de temperatură. Filosoful natural francez Joseph Louis Gay-Lussac a confirmat descoperirea într-o prezentare la Institutul Național Francez la 31 ianuarie 1802, deși a atribuit descoperirea unei lucrări nepublicate din anii 1780 a lui Jacques Charles. Principiile de bază fuseseră deja descrise de Guillaume Amontons și Francis Hauksbee cu un secol mai devreme.
Dalton a fost primul care a demonstrat că legea se aplica în general tuturor gazelor și vaporilor lichidelor volatile dacă temperatura era mult peste punctul de fierbere. Gay-Lussac a fost de acord. Cu măsurători numai la cele două puncte fixe termometrice ale apei (0°C și 100°C), Gay-Lussac nu a reușit să arate că ecuația care raportează volumul la temperatură era o funcție liniară. Numai din motive matematice, lucrarea lui Gay-Lussac nu permite atribuirea vreunei legi care să stabilească relația liniară.
Ecuația matematică nu conține temperatura și nu este ceea ce a devenit cunoscut sub numele de Legea lui Charles. Valoarea lui Gay-Lussac pentru k a fost identică cu valoarea anterioară a lui Dalton pentru vapori și remarcabil de apropiată de valoarea actuală. Gay-Lussac a acordat credit pentru această ecuație declarațiilor nepublicate ale cetățeanului său republican J. Charles în 1787. În absența unei evidențe solide, legea gazelor referitoare la volumul de temperatură nu poate fi atribuită lui Charles. Măsurătorile lui Dalton au avut mult mai multă amploare în ceea ce privește temperatura decât Gay-Lussac, măsurând nu numai volumul în punctele fixe ale apei, ci și în două puncte intermediare. Neconștient de inexactitățile termometrelor cu mercur la acea vreme, care erau împărțite în părți egale între punctele fixe, Dalton, după ce a concluzionat în Eseul II că, în cazul vaporilor, „orice fluid elastic se extinde aproape într-o manieră uniformă în 1370 sau 1380. părți cu 180 de grade (Fahrenheit) de căldură”, nu a putut confirma acest lucru pentru gaze.
Relația cu zero absolut
Legea lui Charles pare să implice că volumul unui gaz va coborî la zero la o anumită temperatură (−266,66 °C conform cifrelor lui Gay-Lussac) sau -273,15 °C. Gay-Lussac a fost clar în descrierea sa că legea nu se aplică la temperaturi scăzute:
dar pot menționa că această ultimă concluzie nu poate fi adevărată decât atâta timp cât vaporii comprimați rămân în întregime în stare elastică; și aceasta necesită ca temperatura lor să fie suficient de ridicată pentru a le permite să reziste la presiunea care tinde să-i facă să preia starea lichidă.
La temperatura zero absolut, gazul posedă energie zero și, prin urmare, moleculele restricționează mișcarea. Gay-Lussac nu avea experiență cu aerul lichid (preparat pentru prima dată în 1877), deși pare să fi crezut (la fel ca și Dalton) că „gazele permanente” precum aerul și hidrogenul pot fi lichefiate. Gay-Lussac lucrase și cu vaporii lichidelor volatile pentru a demonstra legea lui Charles și era conștient că legea nu se aplică chiar deasupra punctului de fierbere al lichidului:
Pot, totuși, să remarc că atunci când temperatura eterului este doar puțin peste punctul său de fierbere, condensarea lui este puțin mai rapidă decât cea a aerului atmosferic. Acest fapt este legat de un fenomen care este manifestat de foarte multe corpuri la trecerea de la starea lichidă la starea solidă, dar care nu mai este sensibil la temperaturi cu câteva grade peste cea la care are loc tranziția.
Prima mențiune despre o temperatură la care volumul unui gaz ar putea coborî la zero a fost făcută de William Thomson (cunoscut mai târziu ca Lord Kelvin) în 1848:
Aceasta este ceea ce am putea anticipa atunci când reflectăm că frigul infinit trebuie să corespundă unui număr finit de grade ale termometrului de aer sub zero; întrucât dacă împingem suficient de departe principiul strict al gradării, enunțat mai sus, ar trebui să ajungem la un punct corespunzător reducerii la nimic a volumului de aer, care ar fi marcat ca −273° din scară (−100/.366). , dacă .366 este coeficientul de dilatare); și prin urmare −273° a termometrului de aer este un punct care nu poate fi atins la nicio temperatură finită, oricât de scăzută este.
Cu toate acestea, „zeroul absolut” pe scara de temperatură Kelvin a fost definit inițial în termenii celei de-a doua legi a termodinamicii, pe care Thomson însuși a descris-o în 1852. Thomson nu a presupus că acesta este egal cu „punctul de volum zero” al legii lui Charles, ci doar a spus că legea lui Charles prevedea temperatura minimă care putea fi atinsă. Cele două pot fi dovedite a fi echivalente prin viziunea statistică a entropiei a lui Ludwig Boltzmann (1870).
Relația cu teoria cinetică
Teoria cinetică a gazelor leagă proprietățile macroscopice ale gazelor, cum ar fi presiunea și volumul, cu proprietățile microscopice ale moleculelor care alcătuiesc gazul, în special masa și viteza moleculelor. Pentru a deriva legea lui Charles din teoria cinetică, este necesar să existe o definiție microscopică a temperaturii: aceasta poate fi considerată convenabil ca temperatura fiind proporțională cu energia cinetică medie a moleculelor de gaz.