Masă atomică
Masa atomică (ma sau m) este masa unui atom. Deși unitatea de masă SI este kilogramul (simbol: kg), masa atomică este adesea exprimată în unitatea non-SI dalton (simbol: Da) – în mod echivalent, unitatea de masă atomică unificată (u). 1 Da este definit ca 1⁄12 din masa unui atom de carbon-12 liber în repaus în starea sa fundamentală. Protonii și neutronii nucleului reprezintă aproape toată masa totală a atomilor, electronii și energia de legare nucleară aducând contribuții minore. Astfel, valoarea numerică a masei atomice atunci când este exprimată în daltoni are aproape aceeași valoare ca și numărul de masă. Conversia dintre masa în kilograme și masa în daltoni se poate face folosind constanta masei atomice.
Masa izotopică relativă poate fi obținută prin împărțirea masei atomice ma a unui izotop la constanta de masă atomică mu, dând o valoare adimensională. Astfel, masa atomică a unui atom de carbon-12 este de 12 Da prin definiție, dar masa izotopică relativă a unui atom de carbon-12 este pur și simplu 12. Suma maselor izotopice relative ale tuturor atomilor dintr-o moleculă este masa moleculară relativă.
Masa atomică a unui izotop și masa izotopică relativă se referă la un anumit izotop specific al unui element. Deoarece substanțele nu sunt de obicei izotopic pure, este convenabil să se folosească masa atomică elementară, care este masa atomică medie (medie) a unui element, ponderată de abundența izotopilor. Greutatea atomică adimensională (standard) este masa izotopică relativă medie ponderată a unui amestec (tipic natural) de izotopi.
Masa atomică a atomilor, ionilor sau nucleelor atomice este puțin mai mică decât suma maselor protonilor, neutronilor și electronilor lor constituenți, din cauza pierderii de masă a energiei de legare (per E = mc2).
Masa izotopică relativă
Masa izotopică relativă (o proprietate a unui singur atom) nu trebuie confundată cu cantitatea medie a greutății atomice, adică o medie a valorilor pentru mulți atomi dintr-o probă dată a unui element chimic.
În timp ce masa atomică este o masă absolută, masa izotopică relativă este un număr adimensional fără unități. Această pierdere de unități rezultă din utilizarea unui raport de scalare în raport cu un standard de carbon-12, iar cuvântul „relativ” din termenul „masă izotopică relativă” se referă la această scalare în raport cu carbonul-12.
Masa relativă izotopică este masa unui izotop dat, atunci când această valoare este scalată de masa carbonului-12, unde acesta din urmă trebuie determinat experimental. În mod echivalent, masa izotopică relativă a unui izotop sau nuclid este masa izotopului relativ la 1/12 din masa unui atom de carbon-12.
De exemplu, masa izotopică relativă a unui atom de carbon-12 este exact 12. Pentru comparație, masa atomică a unui atom de carbon-12 este exact 12 daltoni. Alternativ, masa atomică a unui atom de carbon-12 poate fi exprimată în orice alte unități de masă: de exemplu, masa atomică a unui atom de carbon-12 este 1,99264687992(60)×10-26 kg.
Așa cum este cazul masei atomice aferente atunci când este exprimată în daltoni, numerele de masă izotopice relative ale nuclizilor, alții decât carbonul-12, nu sunt numere întregi, dar sunt întotdeauna apropiate de numere întregi.
Termeni similari pentru cantități diferite
Masa atomică sau masa izotopică relativă sunt uneori confundate, sau folosite incorect, ca sinonime ale masei atomice relative (cunoscută și ca greutate atomică) sau ale greutății atomice standard (o varietate particulară de greutate atomică, în sensul că este standardizată). Cu toate acestea, după cum s-a menționat în introducere, masa atomică este o masă absolută, în timp ce toți ceilalți termeni sunt adimensionali. Masa atomică relativă și greutatea atomică standard reprezintă termeni pentru mediile (ponderate în abundență) ale maselor atomice relative din probele elementare, nu pentru nuclizi unici. Ca atare, masa atomică relativă și greutatea atomică standard diferă adesea numeric de masa izotopică relativă.
Masa atomică (masa izotopică relativă) este definită ca masa unui singur atom, care poate fi doar un izotop (nuclid) la un moment dat și nu este o medie ponderată în funcție de abundență, ca în cazul masei atomice/atomice relative. greutate. Masa atomică sau masa izotopică relativă a fiecărui izotop și nuclid al unui element chimic este, prin urmare, un număr care, în principiu, poate fi măsurat cu o precizie ridicată, deoarece fiecare specimen al unui astfel de nuclid este de așteptat să fie exact identic cu orice alt specimen, deoarece toți atomii de un anumit tip în aceeași stare de energie și fiecare specimen dintr-un anumit nuclid se așteaptă să fie exact identici ca masă cu fiecare alt specimen al acelui nuclid. De exemplu, fiecare atom de oxigen-16 este de așteptat să aibă exact aceeași masă atomică (masă izotopică relativă) ca orice alt atom de oxigen-16.
În cazul multor elemente care au un izotop natural (elemente mononuclidice) sau un izotop dominant, diferența dintre masa atomică a celui mai comun izotop și masa atomică relativă (standard) sau greutatea atomică (standard) poate fi mică. sau chiar zero.
Pentru elementele nemononuclidice care au mai mult de un izotop comun, diferența numerică în masa atomică relativă (greutatea atomică) față de cea mai comună masă izotopică relativă poate fi o jumătate de unitate de masă sau mai mult (de exemplu, a se vedea cazul clorului în care atomul greutatea și greutatea atomică standard sunt de aproximativ 35,45). Masa atomică (masa izotopică relativă) a unui izotop neobișnuit poate diferi de masa atomică relativă, greutatea atomică sau greutatea atomică standard cu mai multe unități de masă.
Masele izotopice relative sunt întotdeauna apropiate de valorile întregului număr, dar niciodată (cu excepția carbonului-12) exact un număr întreg, din două motive:
- protonii și neutronii au mase diferite, și diferiți nuclizi au rapoarte diferite de protoni și neutroni.
- masele atomice sunt reduse, în diferite măsuri, prin energiile lor de legare.
Raportul dintre masa atomică și numărul de masă (numărul de nucleoni) variază de la 0,9988381346(51) pentru 56Fe la 1,007825031898(14) pentru 1H.
Orice defect de masă datorat energiei de legare nucleară este experimental o mică fracțiune (mai puțin de 1%) din masa unui număr egal de nucleoni liberi. În comparație cu masa medie per nucleon în carbonul-12, care este moderat puternic legată în comparație cu alți atomi, defectul de masă de legare pentru majoritatea atomilor este o fracțiune și mai mică a unui dalton (unitatea de masă atomică unificată, bazată pe carbon- 12). Deoarece protonii și neutronii liberi diferă unul de celălalt ca masă printr-o mică fracțiune de dalton ), rotunjind masa izotopică relativă sau masa atomică a oricărui nuclid dat dată în daltoni la cel mai apropiat număr întreg, dă întotdeauna numărul de nucleoni sau numărul de masă. În plus, numărul de neutroni (numărul de neutroni) poate fi apoi derivat prin scăderea numărului de protoni (numărul atomic) din numărul de masă (numărul de nucleoni).
Defect de masă
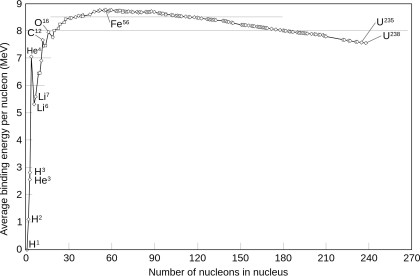
Energia de legare per nucleon al izotopilor comuni. Un grafic al raportului dintre numărul de masă și masa atomică ar fi similar.
Cantitatea de care se abate raportul dintre masele atomice și numărul de masă de la 1 este următoarea: abaterea începe pozitiv la hidrogen-1, apoi scade până când atinge un minim local la heliu-4. Izotopii de litiu, beriliu și bor sunt legați mai puțin puternic decât heliul, așa cum se arată prin raporturile lor crescânde dintre masă și număr.
La carbon, raportul dintre masă (în daltoni) și numărul de masă este definit ca 1, iar după carbon devine mai mic de unu până când se atinge un minim la fier-56 (cu valori doar puțin mai mari pentru fier-58 și nichel-62 ), apoi crește la valori pozitive în izotopii grei, cu creșterea numărului atomic. Acest lucru corespunde faptului că fisiunea nucleară într-un element mai greu decât zirconiul produce energie, iar fisiunea în orice element mai ușor decât niobiul necesită energie. Pe de altă parte, fuziunea nucleară a doi atomi ai unui element mai ușor decât scandiul (cu excepția heliului) produce energie, în timp ce fuziunea în elemente mai grele decât calciul necesită energie. Fuziunea a doi atomi de 4He dând beriliu-8 ar necesita energie, iar beriliul s-ar destrăma rapid din nou. El poate fuziona cu tritiu (3H) sau cu 3He; aceste procese au avut loc în timpul nucleosintezei Big Bang. Formarea elementelor cu mai mult de șapte nucleoni necesită fuziunea a trei atomi de 4He în procesul triplu alfa, sărind peste litiu, beriliu și bor pentru a produce carbon-12.
Istoric
Primii oameni de știință care au determinat masele atomice relative au fost John Dalton și Thomas Thomson între 1803 și 1805 și Jöns Jakob Berzelius între 1808 și 1826. Masa atomică relativă (greutatea atomică) a fost definită inițial în raport cu cea a celui mai ușor element, hidrogenul, care a fost luat. ca 1,00, iar în anii 1820, ipoteza lui Prout a afirmat că masele atomice ale tuturor elementelor s-ar dovedi a fi multipli exacti ai hidrogenului. Berzelius, însă, a dovedit curând că acest lucru nici măcar nu era aproximativ adevărat, iar pentru unele elemente, cum ar fi clorul, masa atomică relativă, la aproximativ 35,5, se află aproape exact la jumătatea distanței dintre doi multipli integrali ai hidrogenului. Mai târziu, s-a demonstrat că acest lucru se datorează în mare parte unui amestec de izotopi și că masele atomice ale izotopilor puri, sau nuclizilor, sunt multipli ai masei hidrogenului, cu aproximativ 1%.
În anii 1860, Stanislao Cannizzaro a rafinat masele atomice relative prin aplicarea legii lui Avogadro (în special la Congresul de la Karlsruhe din 1860). El a formulat o lege pentru a determina masele atomice relative ale elementelor: diferitele cantități ale aceluiași element conținute în molecule diferite sunt toate multipli întregi ai greutății atomice și a determinat masele atomice relative și masele moleculare prin compararea densității vaporilor unei colecții de gaze cu molecule care conțin unul sau mai multe dintre elementele chimice în cauză.
În secolul al XX-lea, până în anii 1960, chimiștii și fizicienii au folosit două scale diferite de masă atomică. Chimiștii au folosit o scară de „unitate de masă atomică” (amu), astfel încât amestecul natural de izotopi de oxigen să aibă o masă atomică 16, în timp ce fizicienii au atribuit același număr 16 numai masei atomice a celui mai comun izotop de oxigen (16O, care conține opt protoni și opt neutroni). Cu toate acestea, deoarece oxigenul-17 și oxigenul-18 sunt de asemenea prezente în oxigenul natural, acest lucru a condus la două tabele diferite de masă atomică. Scara unificată bazată pe carbon-12, 12C, a satisfăcut nevoia fizicienilor de a baza scara pe un izotop pur, fiind în același timp apropiată numeric de scara chimiștilor. Aceasta a fost adoptată ca „unitatea de masă atomică unificată”. Actuala recomandare principală a Sistemului Internațional de Unități (SI) pentru numele acestei unități este daltonul și simbolul „Da”. Numele „unitate de masă atomică unificată” și simbolul „u” sunt nume și simboluri recunoscute pentru aceeași unitate.
Termenul de greutate atomică este eliminat treptat și este înlocuit cu masa atomică relativă, în majoritatea utilizării curente. Această schimbare a nomenclaturii ajunge încă din anii 1960 și a fost sursa multor dezbateri în comunitatea științifică, care a fost declanșată de adoptarea unității unificate de masă atomică și de conștientizarea faptului că greutatea era, într-un fel, un termen nepotrivit. Argumentul pentru păstrarea termenului „greutate atomică” a fost în primul rând că acesta era un termen bine înțeles de cei din domeniu, că termenul „masă atomică” era deja în uz (așa cum este definit în prezent) și că termenul „atomică relativă”. masa" ar putea fi ușor confundată cu masa izotopică relativă (masa unui singur atom al unui nuclid dat, exprimată fără dimensiuni în raport cu 1/12 din masa carbonului-12.
În 1979, ca un compromis, termenul „masă atomică relativă” a fost introdus ca sinonim secundar pentru greutatea atomică. Douăzeci de ani mai târziu, primatul acestor sinonime a fost inversat, iar termenul „masă atomică relativă” este acum termenul preferat.
Cu toate acestea, termenul „greutăți atomice standard” (referindu-se la greutățile atomice standardizate așteptate ale diferitelor probe) nu a fost modificat, deoarece simpla înlocuire a „greutății atomice” cu „masă atomică relativă” ar fi rezultat în termenul „ masa atomică relativă standard”.